Hipertensi Kot Putih Sukar Dikesan Tetapi Mudah Dicegah
Oleh Infomedikini
Pertubuhan Kesihatan Sedunia menganggarkan jumlah penghidap hipertensi di serata dunia adalah seramai 1.13 bilion kes. Ada hipertensi yang bersebab dan ada yang tidak bersebab. Maklumat yang akan saya perincikan adalah tentang definisi hipertensi, pengukuran hipertensi, sejenis hipertensi iaitu hipertensi kot putih: sebab musabab ianya terjadi dan kaedah pencegahannya.
Kot Putih
Kot putih adalah kemeja berwarna putih berlengan panjang atau pendek tetapi ukuran labuhnya ada yang mencecah paras lutut. Kot putih adalah uniform atau pakaian seragam yang lazimnya dipakai samaada di makmal-makmal, di klinik-klinik dan di hospital-hospital.
Kot putih
Penggunaan uniform putih dalam sektor perubatan sudah terlalu lama dipraktikkan. Sebab sebenar kenapa warna putih menjadi pilihan bagi kot tidaklah diketahui tetapi ia seperti ada kaitan dengan aspek ini:
- Murni
- Suci
- Bersih
Tinjauan pendapat dalam kalangan pemakai kot putih mendapati sebab utama ianya dipakai sebagai uniform adalah:
- Pelindung Kekotoran.
- Penyimpanan peralatan.
- Indentifikasi dan pembezaan.
Dengan memakai kot, baju atau kemeja dipakai di belakang kot dapat dilindungi daripada terkena kekotoran.
Selain itu poket-poket yang terdapat pada kot putih akan menyenangkan beberapa peralatan kecil disimpan dan dibawa bersama ketika petugas menjalankan tugas.
Selebihnya bila uniform adalah berwarna putih, identifikasi rakan sekerja menjadi mudah dan kakitangan perubatan dan bukan kakitangan dapat dibeza-bezakan.
Cumanya, sungguhpun kot putih adalah uniform formal dan bersinonim dengan sektor perubatan, pemakaian kot putih sekarang ini sudah beransur-ansur di kesampingkan.
Selalunya kot putih hanya tidak dipakai oleh pakar psikiatri dan pakar kanak-kanak sahaja tetapi kini lebih ramai pengamal perubatan beralih kepada tidak memakai kot putih.
Peralihan ini tiada kaitan dengan keberatan untuk mengikuti kelaziman sebaliknya ada alasan dan justifikasi tersendiri untuk tidak memakai kot sedemikian itu.
Alasan estetik: Adalah sukar untuk menyembunyikan kekotoran pada kot meskipun terkena sedikit bahan pengotor.
Alasan saintifik pula mendapati bila kot putih terutamanya yang berlengan panjang dilekati oleh kuman, kuman tadi boleh disebarkan kepada orang lain.
Alasan psikologi melihat kot putih adalah punca efek kot putih dan pesakit yang terkesan dengan efek kot putih akan berasa cemas, gementar dan gugup.
Hipertensi
Penyakit hipertensi dihidapi bila bacaan tekanan darah adalah lebih tinggi daripada paras tekanan darah normal bagi kelompok usia yang sama. Hipertensi ada 2 jenis: 1. Adalah hipertensi primer iaitu puncanya tidak diketahui. 2. Hipertensi sekunder iaitu bila mana punca diketahui.
Bagi memudahkan pemahaman tentang hipertensi, analogi tekanan angin dalam tayar kenderaan boleh membantu anda. Tayar kenderaan menggunakan tekanan angin bagi mengembungkannya. Tanpa angin, tayar akan mengempis.
Unit tekanan agin dalam tayar kenderaan adalah kPa iaitu kilopascals atau psi iaitu pounds per square inch. Tekanan angin yang sesuai adalah ditentukan oleh pembuat tayar itu sendiri. Tekanan yang disyorkan itu dianggap paling selamat bukan sahaja bagi tayar, paling utama ia selamat buat pemanduan jua.
Makanya, sekiranya angin dipam ke dalam tayar dalam volum yang berlebihan, tekanan udara dalam tayar akan menjadi lebih tinggi daripada paras yang disyorkan, fizikal tayar akan mengembong lebih daripada had yang bersesuaian dan menjadi lebih keras daripada biasa. Kalau misalnya tekanan selamat bagi tayar adalah 200 kPa maka setiap satu unit lebih tinggi daripada nilai tersebut akan menaikkan risiko bahaya terhadap tayar dan seterusnya risiko pemanduan.
Berbalik kepada hipertensi, tekanan darah atau singkatannya BP adalah tekanan yang dihasilkan oleh kuasa pengepaman jantung. Oleh kerana jantung tidak mengepam secara berterusan sebalikya ada fasa rehatnya makanya tekanan darah adalah berubah-ubah. Lazimnya ada dua nilai yang diukur iaitu tekanan sistole yang terhasil bila jantung berkontraksi dan tekanan diastole bila jantung memasuki fasa relaksasi.
Dulu-dulunya BP diukur dengan sfigmomanometer yang menggunakan ketinggian kolum merkuri sebagai bacaan BP. Ada dua bacaan BP iaitu bacaan atas dan bacaan bawah: bacaan atas/bacaan bawah dan unitnya adalah mmHg.
Tanda baca ( / ) yang digunakan di sini bukanlah bermaksud garis pembahagi tetapi garis condong. Kalau contohnya bacaan BP adalah 120/70 mmHg maka ia bukan bermaksud 120 mmHg dibahagikan dengan 70 mmHg.
Maksud sebenarnya adalah bacaan atas atau bacaan sistole bagi tekanan darah tersebut adalah seratus dua puluh milimeter merkuri dan bacaan bawah atau bacaan diastole pula adalah tujuh puluh milimeter merkuri.
Dan kenapa unit milimeter merkuri digunakan bagi tekanan darah adalah bersangkut paut dengan sfigmomanometer. Ia adalah alat pengukur tekanan darah model lama yang menggunakan ketinggian kolum merkuri sebagai unit tekanan darah.
Pengukur Tekanan Darah
Model yang ada sekarang ini tidak lagi menggunakan cecair merkuri tetapi menggunakan pengukur elektronik.
Pengukur BP aneroid
Pengukur BP merkuri
Pengukur BP elektronik
Unit tekanan darah yang diukur oleh alat pengukur aneroid dan pengukur elektronik adalah kPa dan psi. Sungguhpun begitu memandangkan penggunaan unit mmHg bagi tekanan darah adalah terlalu meluas makanya ia dikekalkan.
Hipertensi Kot Putih
Seperti yang diterangkan sebelum ini impak pskologi daripada efek kot putih adalah perasaan cemas, gugup dan gementar. Kesan fisiologi daripada perasaan ini adalah jantung berdebar, nafas kencang dan tekanan darah menaik sebanyak 10 mmHg.
Ini bermakna kot putih boleh menyebabkan hipertensi. Biar betul? Sebetulnya itulah kebenarannya dan ianya berlaku bila efek kot putih secara tidak langsung menaikkan bacaan tekanan darah individu ke paras yang boleh di kategorikan sebagai hipertensi!
Hipertensi yang dikaitkan dengan efek kot putih telah mula dikesan bila pengukur BP model separa automatik memasuki pasaran. Ini membolehkan pesakit mengukur BP sendiri sewaktu di rumah dan ukuran ini boleh dibandingkan dengan ukuran BP di klinik.
Nah! suatu yang 'aneh' berlaku apabila bacaan tekanan darah yang diukur di rumah dibandingkan dengan ukuran yang dibuat di klinik. Kerap kalinya bacaan di klinik adalah beberapa mmHg lebih tinggi daripada bacaan yang direkodkan di rumah.
Kalau ya pun apa isunya? Isu akan timbul bilamana tekanan darah yang diambil di klinik adalah dalam julat hipertensi tetapi ukuran yang diambil di rumah adalah normal. Situasi ini menyukarkan diagnosis dibuat.
Seperti yang diperjelaskan di atas, bacaan BP yang tinggi di klinik adalah disebabkan oleh efek kot putih. Makanya dianosis yang sesuai bagi kes sebegini adalah hipertensi kot putih.
Kesan Sampingan
Hampir semua pemeriksaan kesihatan seperti dapat masuk ke IPT, sambung belajar di luar negara, penyertaan dalam sukan, diterima sebagai pekerja baru, permohonan atau pembaharuan lesen PSV/GDL dan banyak lagi adalah berkehendakkan bacaan BP direkodkan.
Sekiranya hipertensi dikesan semasa pemeriksaan kesihatan tetapi kemungkinan hipertensi tersebut adalah hipertensi kot putih tidak pula diambil kira makanya pihak yang diperiksa boleh dianggap tidak sihat.
Cegah Hipertensi Kot Putih
Menyedari adanya masalah yang boleh dicetuskan oleh hipertensi kot putih, justeru ianya perlulah dicegah. Berikut adalah cara-caranya:
- Cara psikologikal
- Cara spiritual
- Cara fisiologikal
Kaedah psikologi boleh digunakan bagi mengawal perasaan. Perasaan cemas, gemuruh dan gugup dapat diredakan jika pihak yang mahu menjalani pemeriksaan kesihatan di berikan masa secukupnya untuk berehat dan bertenang secara berseorangan dalam bilik yang berasingan.
Satu lagi cara yang boleh dilakukan adalah kawalan pernafasan:
- Cara ini memerlukan pelakuknya duduk tegak di kerusi.
- Mulakan pernafasan dengan inhalasi (tarik nafas) sedalam yang boleh tetapi pada kadar yang perlahan.
- Seterusnya lakukan ekshalasi (hembus nafas) semaksimum yang boleh juga pada kadar yang perlahan.
- Inhalasi dan ekshalasi perlu diulang-ulang pada kadar 6 kali bagi setiap 30 saat.
Kawalan pernafasan dapat menurunkan tekanan darah sehingga 10 mmHg.
BP 115/74 mmHg sebelum kawalan pernafasan.
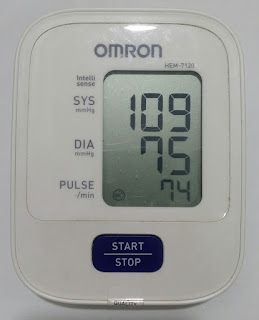
BP turun kepada 109/75 mmHg selepas kawalan pernafasan.
Penutup
Sesiapa saja boleh terkena efek kot putih. Namun tidak semua orang akan mendapat hipertensi kot putih. Anda boleh jadi gemuruh cemas dan gementar semasa tekanan darah diukur tanpa anda atau doktor anda menyedari mengenainya. Pengesahan boleh dibuat dengan membandingkan ukuran yang dibuat di rumah dan di klinik.
Kalau anda mengalami efek kot putih semasa tekanan darah diukur di klinik, apa yang anda boleh lakukan adalah mengawal perasaan cemas, gementar dan gugup. Ini boleh dilaksanakan dengan mengambil sedikit masa untuk berehat, bertenang dan menyejukkan badan. Tindakan ini boleh membantu dalam mengembalikan tekanan darah ke paras normal.
Penghidap hipertensi kot putih berkemungkinan mendapat hipertensi primer di masa depan. Justeru penghidap hipertensi kot putih adalah disarankan supaya menjalani pemeriksaan BP secara nalar setiap 6-12 bulan sekali supaya intervensi awal dapat diambil.
Last-Modified: Thursday, 16 December 2021 23:07:08 GMT
Home🏠




















Ulasan